CVOID-19研究應用
冠狀病毒是一大類病毒,通常引起輕度至中度的上呼吸道感染。SARS-CoV-2是一種動物源性病原體(一種具有跨物種感染並感染多個寄主的病毒),負責目前的COVID-19大流行。已經有許多關於這種病毒如何傳播以及如何對易感人群引起呼吸衰竭和敗血症的細節被確定。然而,COVID-19周圍仍有一些重要的科學問題未被解答:
- 為什麼有些低氧患者繼續正常呼吸(無聲低氧血症),而其他人則變得嚴重呼吸困難?
- 為什麼一些患有通常符合肺的患者(L表型)有時會轉變為高彈性肺(H表型)?
- 是否存在預測性標記以確定患者對醫療干預(藥物、一氧化氮治療、俯臥位通氣)的反應? 如何在進行複雜而昂貴的臨床試驗之前更好地驗證新型治療和疫苗?
COVID研究的另一個重要考慮因素是是否需要進行BSL3實驗 - 這是個問題!由於其高毒性,需要在動物生物安全等級3(ABSL-3)設施中使用SARS-CoV-2病原體。BSL-3實驗室需要全面的個人防護裝備(PPE)和嚴格的安全協議,以確保實驗室人員的安全。直接研究像SARS-CoV-2這樣的危險病原體是必要的,以了解它們的傳播機制、複製過程和致病機制。
許多沒有BSL-3設施的科學家渴望參與抗擊COVID-19。雖然在傳統實驗室(非BSL-3)工作的科學家不能直接與SARS-CoV-2一起工作,但他們可以採用不同的建模技術來模擬疾病的症狀。代理模型可以重現COVID-19的特定元素,例如肺損傷或肺炎,以及導致某些患者對COVID-19更加脆弱的免疫反應的各種組成部分。
BSL-3 Models
有Biosafety Level-3 (BSL-3) 實驗室的研究人員可以依賴不同的動物模型來研究 COVID-19:
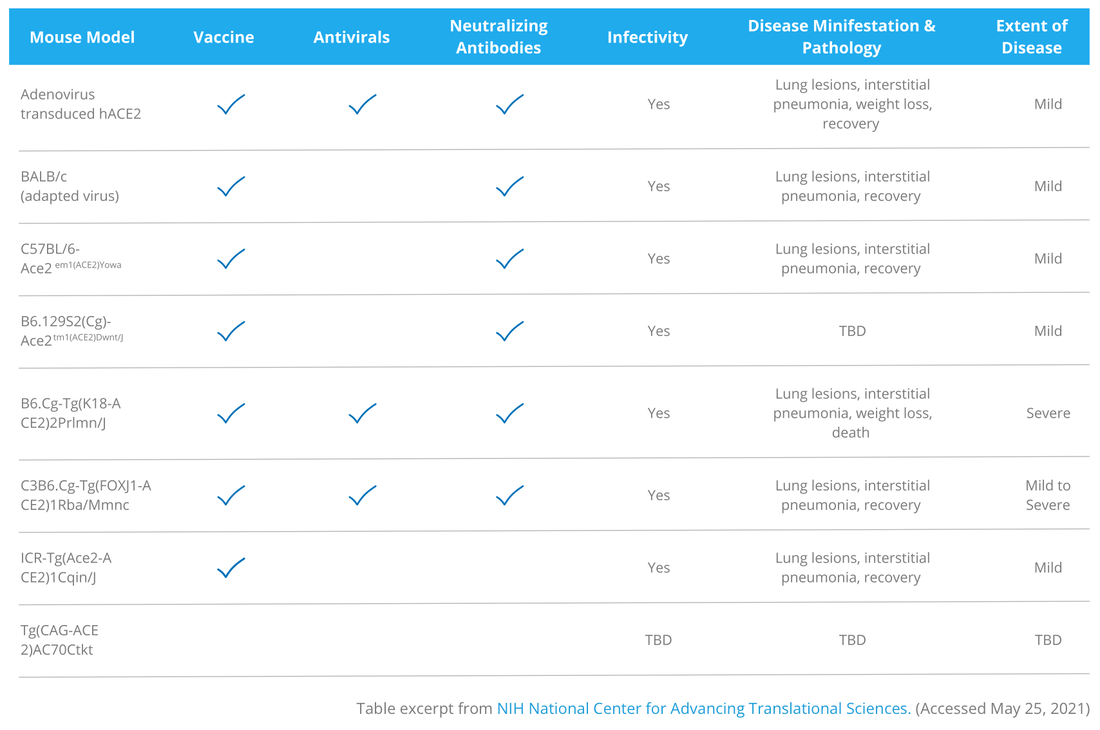
小鼠模型 Mouse Model
小鼠(Mouse)通常是生物醫學研究的首選對象,因為科學文獻中有大量參考資料、可以基因操作、成本低、壽命短等優勢。但對於 COVID-19 研究人員來說,老鼠身上的 ACE2 受體(在感染時首先與 SARS-CoV-2 結合的受體)與人類的不同很大,因此老鼠不會出現 COVID-19 的症狀,除非他們的免疫系統受損或使用老化模型。因此,科學家依賴各種技術來使小鼠人類同質化(humanize)並使其對疾病更加敏感。
小鼠模型 Mouse Model
小鼠(Mouse)通常是生物醫學研究的首選對象,因為科學文獻中有大量參考資料、可以基因操作、成本低、壽命短等優勢。但對於 COVID-19 研究人員來說,老鼠身上的 ACE2 受體(在感染時首先與 SARS-CoV-2 結合的受體)與人類的不同很大,因此老鼠不會出現 COVID-19 的症狀,除非他們的免疫系統受損或使用老化模型。因此,科學家依賴各種技術來使小鼠人類同質化(humanize)並使其對疾病更加敏感。
- Dr. Stanley Perlman, a scientist at the University of Iowa, developed a two-step approach to infect mice with SARS-CoV-2. The mice are first exposed to an adenovirus expressing the human ACE2 receptor, then exposed to SARS-CoV-2, which binds to the human ACE2 receptor. The adenovirus is available from the Viral Vector Core at the University of Iowa.
- Another approach developed by Dr. Perlman uses transgenic mouse models (hACE2-mice) developed by the McCray Lab, which express the human ACE2 receptor and are vulnerable to SARS-CoV-2. These mice are available from Jackson Labs.
- Additionally, a new NCG-hACE2 mouse model was developed by Charles River Laboratories for preclinical COVID-19 research. This model works with engrafting of human cells from patients infected with COVID-19. The NCG-hACE2 mouse can imitate the cytokine storm caused by SARS-CoV-2 which has been an important factor in clinical disease progression.
金色敘利亞倉鼠 Golden Syrian hamster(Mesocricetus auratus)
倉鼠正迅速成為抗擊 COVID-19 的重要動物模型。敘利亞倉鼠暴露於 SARS-CoV-2 後,重要的篩選終點包括感染引起的體重下降(15-20%)、病毒負載、犧牲後的肺重量、昏沉和呼吸模式的變化。此外,受疾病影響的敘利亞倉鼠能持續感染與其同住的幼鼠。所有被感染的敘利亞倉鼠最終都康復並產生抗體。敘利亞倉鼠模型重現了科學家尋求的許多病毒複製特徵和臨床症狀,並且很可能在 COVID-19 研究實驗室中變得更加普遍。
除了動物模型外,研究人員還可以使用其他建模技術來研究COVID-19。例如,科學家可以使用器官移植模型來研究病毒如何影響不同類型的人類器官。
大型動物模型(如大鼠、雪貂、非人靈長類動物)
對抗COVID-19的鬥爭可能涉及多種其他研究模型,包括大鼠、雪貂、豬和靈長類動物。
對於感染性研究,大鼠與小鼠模型相比優勢有限,因為它們的ACE2受體與SARS-CoV-2病原體的親和力較低。但值得注意的是,它們是更大的實驗對象,因此在實驗過程中可以取得更多的生物樣本。
另一方面,雪貂是一個很有前途的模型,因為SARS-CoV-2病毒會在它們的肺和腸道中覆制,並且已被證明它們能夠將病毒傳播到相鄰的籠子里。目前,在雪貂模型中沒有明確的COVID-19臨床表現,盡管它的呼吸生理更接近人類。雪貂的氣道樹比小鼠更多,它們可以咳嗽和打噴嚏,這對其他肺部疾病的研究也證明很有啟發性。
非人靈長類動物(NHPs)在傳染病研究中是不可或缺的,因為它們與人類有許多共同的生物途徑,這使它們成為生物制劑和疫苗開發的重要模型。然而,出於倫理考慮、有限的可用性和成本問題,將靈長類動物用於生命科學研究的範圍僅限於少數高度專業化的中心。
倉鼠正迅速成為抗擊 COVID-19 的重要動物模型。敘利亞倉鼠暴露於 SARS-CoV-2 後,重要的篩選終點包括感染引起的體重下降(15-20%)、病毒負載、犧牲後的肺重量、昏沉和呼吸模式的變化。此外,受疾病影響的敘利亞倉鼠能持續感染與其同住的幼鼠。所有被感染的敘利亞倉鼠最終都康復並產生抗體。敘利亞倉鼠模型重現了科學家尋求的許多病毒複製特徵和臨床症狀,並且很可能在 COVID-19 研究實驗室中變得更加普遍。
除了動物模型外,研究人員還可以使用其他建模技術來研究COVID-19。例如,科學家可以使用器官移植模型來研究病毒如何影響不同類型的人類器官。
大型動物模型(如大鼠、雪貂、非人靈長類動物)
對抗COVID-19的鬥爭可能涉及多種其他研究模型,包括大鼠、雪貂、豬和靈長類動物。
對於感染性研究,大鼠與小鼠模型相比優勢有限,因為它們的ACE2受體與SARS-CoV-2病原體的親和力較低。但值得注意的是,它們是更大的實驗對象,因此在實驗過程中可以取得更多的生物樣本。
另一方面,雪貂是一個很有前途的模型,因為SARS-CoV-2病毒會在它們的肺和腸道中覆制,並且已被證明它們能夠將病毒傳播到相鄰的籠子里。目前,在雪貂模型中沒有明確的COVID-19臨床表現,盡管它的呼吸生理更接近人類。雪貂的氣道樹比小鼠更多,它們可以咳嗽和打噴嚏,這對其他肺部疾病的研究也證明很有啟發性。
非人靈長類動物(NHPs)在傳染病研究中是不可或缺的,因為它們與人類有許多共同的生物途徑,這使它們成為生物制劑和疫苗開發的重要模型。然而,出於倫理考慮、有限的可用性和成本問題,將靈長類動物用於生命科學研究的範圍僅限於少數高度專業化的中心。