|
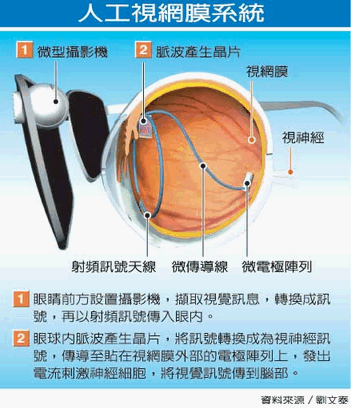
人工視網膜為台灣交通大學所開發出來的一項跨時代革命性產品,它主要涵蓋了生物及非生物系統間的銜接,讓小型化、集成化、系統及軟硬體進行高度整合,使失明患者恢復視覺功能。 人大腦中的視覺是由視網膜內的感光細胞偵測外界物體的光波後,經其他細胞功能的處理,傳導至視網膜上方的神經節細胞(ganglion cell)轉成脈衝,再經由視神經傳送到大腦皮質層才產生視覺,而不同種的視網膜細胞所偵測到亦不同,如物體的移動方向、形狀、顏色、輪廓、明暗等,進而產生不同種的脈衝訊號,因此,人工視網膜晶片需具備各種物體的特徵辨識功能,在微形晶片植入患者的視網膜後,利用多重電壓、類比數位混和自我供電、資料管理及小攝影機等,將拍到的影像透過晶片傳遞到人的大腦做分辨,來取代受損的視網膜細胞,使患者重見天日。 交通大學教授劉文泰成功研發出人工視網膜「阿格斯第2代系統(Argus II system)」,該產品是以電極取代患者受損的視網膜細胞,再經由特製眼鏡拍到的影像,轉換成電子數據無線傳輸到電極,使患者感知周圍環境明暗,辨識物體的輪廓、移動方向及具體的影像,如:報紙標題及杯子等。產品於2013年2月14日獲美國FDA核准上市,未來可在美國合法植入人眼,造福因視網膜病變而失明的病患,此突破性的創新研究讓台灣在全球醫療史上寫下了新頁。 另一項創舉為德國Retina Implant公司研發的「阿爾發IMS系統(Alpha IMS)」,該系統主要是利用在視網膜後方連接微晶片再讓大腦處理數據的方式,讓患者恢復部分視力。該微形晶片長寬僅3毫米、厚度小於100微米,晶片上還負載1500個感光器,可負責接受訊號到大腦,大腦神經經過電脈衝處理數據信號後,可產生約1500像素的黑白影像,而晶片所需能源主要來自於隱藏在耳後的無線供電設備,使用者可通過調節按鈕來改變靈敏度。 以上資料轉載DJ財經百科提供,僅供參考,公司資訊實際以公開說明書為主。
1 評論
腫瘤免疫和Car-T臨床前研究中如何選擇正確的小鼠模型 腫瘤免疫治療大概是目前最火熱的創業和投資領域了,尤其是腫瘤免疫抗體藥物和Car-T治療領域。對於一個創新藥物,需要經過一系列的臨床前和臨床試驗,以證明其“有效”和“安全”,才能被批准上市併進入醫生的處方裡,當然腫瘤免疫抗體藥物和Car-T也不例外。新藥臨床試驗不管是成功還是失敗,都是一項花費巨大的工程,這就需要我們儘可能全面地通過臨床前試驗來對這些新藥進行仔細的評價,以提高臨床成功率。找到最合適的動物模型,往往可以給我們提供最可靠的數據。那麼,在腫瘤免疫抗體藥物和Car-T這種新型藥物研發中,應該如何選擇動物模型呢? 在選擇體內藥效評價模型方面,小鼠無疑是最常用的動物模型。首先,小鼠的繁殖快,可以快速得到有統計學意義的同周齡、同性別、且足量的小鼠;第二,有足夠多的近交系小鼠腫瘤細胞系可以使用;第三,容易建立較穩定的動物-腫瘤模型體系,建立標準化的藥效評價平台。
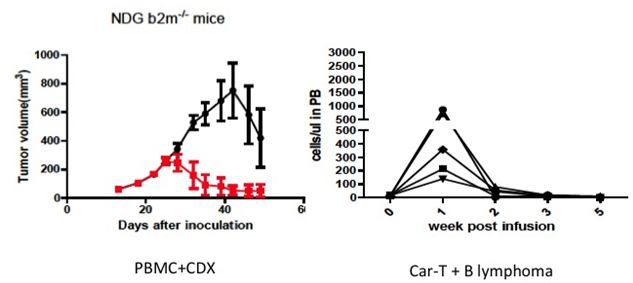
然而,通過對比小鼠和人基因序列發現,普通小鼠的很多基因與對應的人類基因之間,在蛋白胺基酸序列上的同源性經常不是足夠高。所以,一般情況下,識別人蛋白的抗體,並不識別小鼠相應基因蛋白。也就是說,我們一般不能用普通小鼠來評價抗人蛋白抗體的藥效。這就需要對小鼠的基因進行人源化改造。比如,以免疫檢查點PD-1為例,將小鼠的PD1基因換成人的PD-1基因,所得到的PD-1人源化小鼠就可以用來做anti-human PD1抗體的藥效評價。除了PD-1以外,百奧賽圖基本完成了所有小鼠免疫檢查點的人源化改造、進行了藥效驗證、並實現了規模化供應。這些小鼠將助力國內外腫瘤免疫抗體藥物的研發。 這種基因編輯人源化小鼠模型的優勢是,因為小鼠本身的免疫系統是完整的,非常適合針對同一靶點的不同單克隆抗體之間藥效和毒性的精確比較。在R&D階段找到藥效最好、安全性最好的候選抗體,會提高最終抗體成藥的成功率。 然而,畢竟人源化小鼠從製備、繁殖、鑒定、評價、到成為藥效驗證的平台需要超過2年的時間,不是所有靶點都能有現成的基因編輯人源化小鼠。而且,有的研究者認為,通過人免疫系統重建之後的小鼠,也許跟人體真實情況更接近一些。利用重度免疫缺陷小鼠(如JAX的NSG,百奧賽圖的B-NDG小鼠等)進行免疫重建,也是一種可行的替代方案。 一種方法是將人的外周血單核細胞(PBMC)直接注射到重度免疫缺陷小鼠裡進行免疫重建,其優勢在於PBMC已經是人體內發育成熟的免疫細胞。但由於PBMC的T細胞受體注射到小鼠體內後,會非特異地識別小鼠的MHC,導致人T細胞(尤其是CD8+ T細胞)在小鼠體內大量增殖,分泌大量的細胞因子,最終引起GvHD(移植物抗宿主反應),5-6周內導致小鼠體重下降和死亡。如果在這種免疫重建的小鼠裡接入腫瘤,由於體內大量活化的T細胞和細胞因子的存在,將使腫瘤免疫藥效試驗的結果非常複雜和不穩定,雖然可以做一些定性試驗,但很難精確比較不同抗體的藥效和安全性。 另一種方法是從臍帶血中分離CD34+成血幹細胞,注射到經過輻照或新生的重度免疫缺陷小鼠裡。經過3-4個月的體內細胞發育分化,會得到人的免疫細胞。因為這種小鼠沒有人T細胞發育所必需的人的胸腺,所以得到的免疫細胞免疫功能是有缺陷的,其體液免疫(B細胞免疫)也是有缺陷的。不過,這種方式得到的小鼠可以在一定程度上滿足腫瘤免疫藥物研發的需求,雖然實驗結果不穩定,批間差比較大。 更複雜的方式是同時移植胎兒胸腺、胎肝和骨髓組織(即BLT模型),但是這種方法的製備成本太高,也很難批量製備,所以,只適合於科學研究,卻不能滿足藥物研發所要求的大批量、穩定和可重複的要求。 近幾年,NSG和B-NDG這樣的重度免疫缺陷小鼠也廣泛用於Car-T的藥效評價,也獲得了不錯的結果,尤其是針對B細胞淋巴瘤的Car-T試驗。然而,雖然我們看到了B細胞淋巴瘤被Car-T細胞清除了,從免疫學的基本知識可以知道,Car-T在小鼠體內的行為方式跟人體內是不同的。 Car-T的製備過程是將患者自身T細胞進行體外激活並轉染表達抗原(比如CD19, BCMA等)特異性抗體基因,然後再回輸到患者體內。也就是說,Car-T帶有兩種受體,即TCR和BCR(抗體)。做為自身T細胞,在沒有抗原刺激的情況下,Car-T回輸後在人體內是不會擴增的(在忽略體外T細胞激活導致的瞬時體內增殖情況下),Car-T在體內擴增的動力主要是來源於Car-T上的抗體跟抗原的結合。在腫瘤細胞被清楚後,Car-T細胞群會迅速萎縮,或許留下一小部分Car-T記憶細胞。 然而,在免疫缺陷小鼠體內,與PBMC相似,Car-T會通過其TCR被小鼠的MHC激活,造成Car-T的大量非特異性擴增,以及釋放大量細胞因子。即使腫瘤細胞被Car-T清除之後,Car-T也不會像在人體內一樣快速萎縮,而是會跟PBMC一樣,繼續增殖,從而導致GVHD。尤其在實體瘤研究方面,我們並不希望Car-T在小鼠體內大量非特異地增殖,從而影響實驗結果的判斷。因為在小鼠內,Car-T的激活和擴增並不主要是由腫瘤抗原推動的。瞭解所用的小鼠並找到好的模型將會讓我們更好的評價Car-T的藥效以及安全性。 那有沒有更好的模型呢?理論上,MHC缺失的免疫缺陷小鼠會更好一些。如果將PBMC注射到MHC缺失的小鼠裡,PBMC裡的T細胞因為不會被小鼠MHC非特異刺激,也就不會瘋狂地增殖,從而將GVHD的發生時間很大程度的延遲。如果將PBMC和人的腫瘤接種到MHC缺失的重度免疫缺陷小鼠裡,將會給研究者更長的實驗窗口期,更好的模擬人體內的抗腫瘤免疫反應併進行藥效研究。因為PBMC比臍帶血CD34+細胞更容易獲得,也將極大地提高製備效率和產能,滿足醫藥研發所要求的大批量、穩定和可重複。 至少在MHC class I 缺失(b2m敲除)的B-NDG-b2m小鼠裡,我們可以看到,接種PBMC和人腫瘤後,如果進行腫瘤免疫抗體藥物處理,會觀察到腫瘤被抑制,同時在可觀察的時間窗口內,沒有見到體重下降(GVHD)。所以,在B-NDG-b2m小鼠裡植入人腫瘤細胞,並注射人PBMC模型,所製備的模型可以更好的進行腫瘤免疫藥物的藥效評價。與臍帶血CD34+細胞重建模型不同,PBMC重建小鼠裡的免疫細胞功能是完善的,而且還極大地縮短了模型製備時間。 B-NDG-b2m小鼠也非常適合於Car-T的藥效研究。將人腫瘤細胞注射到小鼠體內,4天后給小鼠注射Car-T,可以看到腫瘤細胞被清除,同時,也可以看到血液中Car-T細胞數量的激增,然後隨著腫瘤細胞的清除伴隨血液中Car-T數量的下降。這說明Car-T細胞在MHC敲除小鼠裡不會非特異地大規模增殖,更真實地模擬了人體內Car-T的作用方式。這對於研究Car-T的安全性也具有更好的指導意義。 我相信隨著新模型的不斷湧現,會找到更好的用於腫瘤免疫抗體和Car-T藥效評價的人免疫系統重建小鼠模型。 |
關於昇等生物科技
|
產品分類
實驗規劃諮詢與建議
|
代工服務
|
技術資料
關於我們
|
TEL:02-2651-5827 ; FAX:02-2739-0400
地址:106 台北市和平東路二段76巷19弄4號
No. 4, Aly. 19, Ln. 76, Sec. 2, Heping E. Rd., Da’an Dist., Taipei City 106, Taiwan (R.O.C.)
地址:106 台北市和平東路二段76巷19弄4號
No. 4, Aly. 19, Ln. 76, Sec. 2, Heping E. Rd., Da’an Dist., Taipei City 106, Taiwan (R.O.C.)
|
聯絡我們 e-mail:[email protected] 歡迎加入LINE ID:abi.tech<昇等生物技術支援>
|